相同点:均能实现高纯度、高活性的细胞分选。
不同点:美天旎磁珠因磁珠粒径小,磁性弱,需要搭配分选柱进行磁性的放大才能实现细胞分离,操作时长约30-60分钟(分选柱需预冲洗、上样、洗涤等步骤)。海狸细胞分选试剂盒不需要分选柱,仅需磁力架搭配流式管,最快15分钟(阴选法)即可分离细胞。
用于细胞分选磁力架的磁场强度要>7000Gs,否则会影响细胞分选效果。
推荐海狸细胞分选磁力架(Cat.No: 60205,60205Ⅱ,60206)。
我们未对激活处理后的脾脏或淋巴细胞进行T细胞分选验证。
从理论上讲,阴选方式由于不直接结合目标细胞,通常不受激活处理影响;而阳性选择则可能受到一定影响,尤其是在T细胞激活后某些表面标志物表达发生变化的情况下,可能存在洗脱效率降低的风险。
建议客户在完成细胞分选后再进行激活处理,可以确保分选效果和细胞状态的稳定性。
正常情况下,一个脾脏大概的细胞数量是5x10*7-1x10*8。
但细胞数量与鼠龄、小鼠品系还有单细胞悬液制备都有关系.
可以,海狸的细胞分选试剂盒,从组织或者其他样本里分选出来的都是原代细胞。
圈所有染上色的细胞,(要看染的部位,细胞碎片、死细胞染不上)。
E1左下角细胞碎片不要圈,P1圈对角线(单个核细胞)
可能是磁吸不充分导致的,可以延长磁吸时间或更换磁性更强的磁力架(>7000Gs)。
我们自己用的300 nm的SA(Cat. No. 22308C)做细胞分选,包括阳选和阴选。
目前有客户用的1μm SA(Cat. No. 22307)自己做分选,效果也很好。
含有2 mM EDTA和2% 胎牛血清(FBS)的PBS或者含有2 mM EDTA和0.5% BSA的PBS,需预先通过0.22μm滤膜过滤除菌。可以联系海狸生物购买预配制的分选buffer(Cat. No. 80301)。
自己配制分选buffer时建议使用0.5 M的液体EDTA。原因:固体的EDTA比较难溶解,溶解后也可能会有肉眼看不到的颗粒,所以要过0.22μm的滤膜,但过滤膜可能会损失掉部分EDTA,所以建议用液体的。
因为抗体mix中只有少量的红细胞抗体,防止有红细胞残留,所以需要裂红。
阳选中只有一种抗体,即针对目的细胞的抗体;阴选中是抗体mix,含有多种针对非目标细胞的抗体。
阳选法:适用样本类型多种、复杂,抗体类型单一,需要解离试剂,直接捕获,细胞没有磁珠标记,有抗体标记,操作时长最快80min,不需要分离柱。
阴选法:适用样本类型相对单一,抗体类型为多种抗体的混合物,不需要解离试剂;间接捕获,不影响细胞性能;细胞没有磁珠标记和抗体标记,操作时长最快25min,不需要分离柱。
含有2 mM EDTA和2% 胎牛血清(FBS)的PBS或者含有2 mM EDTA和0.5% BSA的PBS,需预先通过0.22μm滤膜过滤除菌。可以联系海狸生物购买预配制的分选buffer。
推荐进行2次过筛。
第一次过筛:将样本置于70 μm细胞筛网筛网上进行研磨/冲洗,收集细胞。
第二次过筛:裂红完成后,使用PBS重悬细胞,将细胞悬液用70 μm细胞筛网过滤。
若只进行1次过筛,残留的细胞团块可能会导致细胞/磁珠聚集,降低分选纯度。
磁珠使用前需要用分选buffer清洗2次(清洗方法见说明书);若不清洗,磁珠保存液中的某些组分(如抑菌剂)可能会影响细胞活性。
将细胞悬液加到离心管底部,再加入Biotin-Antibody Mix,充分吹打混匀(尽量在底部进行吹打,不要溅到管壁上),4°C孵育 10 min(勿将Ep管插进冰里)。
若孵育时间不足,会使抗体与细胞无法充分结合,从而导致非目标细胞残留,影响分选纯度。
要使用细胞分选专业磁力架,推荐(Cat. No. 60205/60206),静置5分钟,磁吸后转移大部分悬液至新管,注意不要吸到磁珠。磁吸时间过短可能会导致部分磁珠未完全吸附,分选后的细胞中有磁珠残留,且影响分选纯度。
常规离心条件为500 g,5分钟(磁珠清洗除外,需10000 g,1分钟)。离心速度过大(超过500g)影响细胞活性。
分选后的细胞悬液可直接用于流式检测、细胞培养、RNA/蛋白提取等实验;若不立即使用可在4℃短期保存(≤2小时)。因小鼠中性粒细胞体外生存周期短,分选后的细胞,建议尽快安排实验。
一般情况下,股骨和胫骨大概2x10^7~5x10^7个细胞,因个人操作差异原因,有所不同。
正常小鼠1ml的外周血可以拿到 2~4 × 10^6个白细胞(若小鼠为炎症模型,白细胞数可显著升高),其中中性粒细胞占比大概为15%-25%(不同品系有所不同),可以计算一下最多能提出的中性粒细胞数。
得率在50%-70%都是正常的(分选前中性粒细胞占比x总的细胞数量x50%-70%)
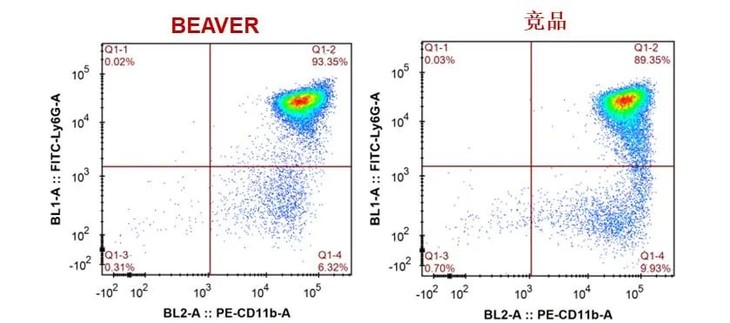
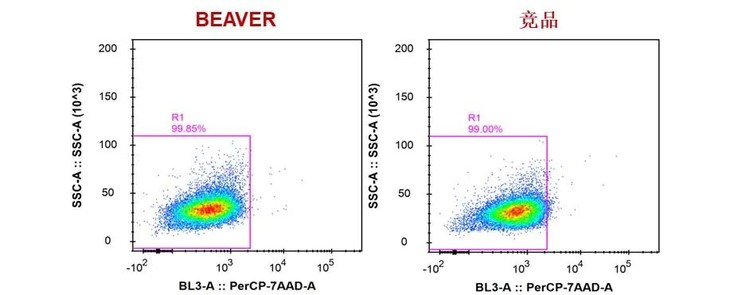
以下是WT小鼠骨髓细胞、脾脏细胞、外周血分选前后纯度:
小鼠骨髓细胞,分选前后CD11b+ Ly6G+ 中性粒细胞的纯度为:45.72%和95.18%。
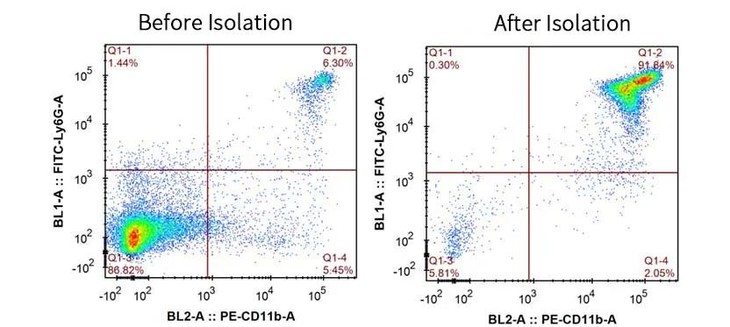
小鼠脾脏细胞,分选前后CD11b+ Ly6G+ 中性粒细胞的纯度为:6.30%和91.84%。
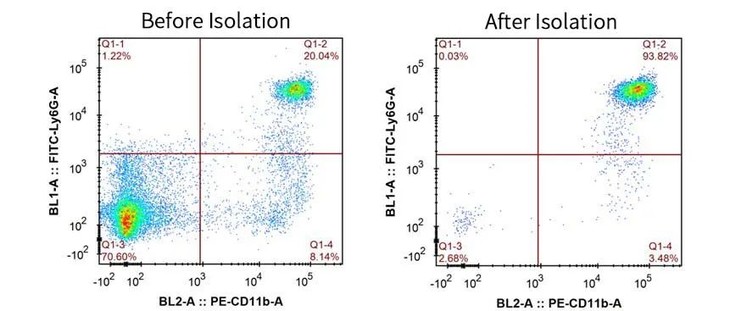
小鼠外周血,分选前后CD11b+ Ly6G+ 中性粒细胞的纯度分别为:20.04%和93.82%。
适用于分选小鼠骨髓、外周血或脾脏中性粒细胞,不适用于其他样本类型(如肝脏、肺组织等)。原因在于该试剂盒采用阴选法,用生物素标记抗体结合非目标细胞,再通过磁珠去除。其他样本中的非目标细胞类型可能不同,缺少对应的抗体标记,会导致分选纯度下降。
可根据样本类型来决定是否需要裂解红细胞(如:小鼠骨髓细胞不裂解红细胞也可直接进行分选,但分选细胞纯度可能随红细胞占比增加有5%以内小幅度下降);裂红时,可根据组织样本及所用裂解液的不同调整用量及时间(如:小鼠外周血样本裂解需要相对更长的时间,若一次裂解不充分,也可进行二次裂解)。
每100 μL细胞悬液(含1×10⁷个细胞)需加入2 μL Biotin-Antibody Mix 和20μL清洗过的磁珠。分选细胞数量增加时,需按比例扩大抗体和磁珠用量(详见说明书)。
细胞浓度过高或过低都会影响分选效果。细胞浓度过高时,细胞容易聚集,导致抗体和细胞结合不充分,部分非目标细胞可能无法被很好的标记,进而影响分选纯度;细胞浓度过低则会导致目标细胞得率降低。

![]()